Page 542 - Advanced Organic Chemistry Part B - Reactions & Synthesis
P. 542
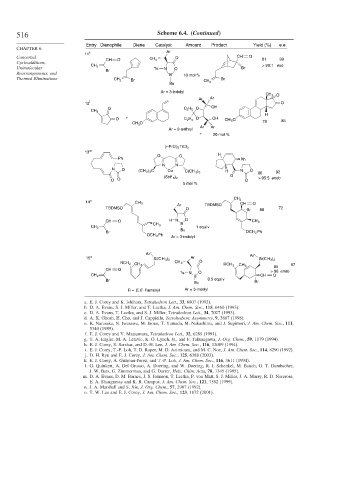
516 Scheme 6.4. (Continued)
Entry Dienophile Diene Catalyst Amount Product Yield (%) e.e.
CHAPTER 6
k Ar
11
Concerted CH O CH 3 O CH O 81 99
Cycloadditions,
Unimolecular CH 2 Ts N O Br > 99:1 exo
Rearrangements, and Br B 10 mol %
Thermal Eliminations CH 2 Br Br
Bu CH 2
Ar = 3-indolyl
CH 3 O
Ar Ar
l
12 O
O C 2 H 5 O OH
CH 3
H
O + C 2 H 5 O OH CH 3 O 85
CH 3 O 78
Ar Ar
Ar = 9-anthryl
+ 20 mol %
(i-PrO) 2 TiCl 2
13 m
O O H
Ph Ph
N N
N O (CH 3 ) 3 C Cu C(CH 3 ) 3 H N O 92
O 86
O O (SbF 6 ) 2 O > 95:5 endo
5 mol %
CH 3
14 n CH 3 CH O
Ar TBDMSO
TBDMSO O Br 88 72
CH O H N O CH 3
CH 3 B
CH 2 1 equiv
Bu
Br OCH 2 Ph
OCH 2 Ph
Ar = 3-indolyl
Ar′ Ar′
o
15 Si(CH 3 ) 2 Ar Si(CH 3 ) 2
RCH 2 CH 3 O
CH 3 RCH 2 CH 3 85 97
CH O
Ts N O > 98 endo
CH 2 B CH O
Br 0.5 equi v
Bu Br
R = E,E -Farnesyl Ar = 3-indolyl
a. E. J. Corey and K. Ishihara, Tetrahedron Lett., 33, 6807 (1992).
b. D. A. Evans, S. J. Miller, and T. Lectka, J. Am. Chem. Soc., 115, 6460 (1993).
c. D. A. Evans, T. Lectka, and S. J. Miller, Tetrahedron Lett., 34, 7027 (1993).
d. A. K. Ghosh, H. Cho, and J. Cappiello, Tetrahedron: Asymmetry, 9, 3687 (1998).
e. K. Narasaka, N. Iwasawa, M. Inoue, T. Yamada, M. Nakashima, and J. Sugimori, J. Am. Chem. Soc., 111,
5340 (1989).
f. E. J. Corey and Y. Matsumura, Tetrahedron Lett., 32, 6289 (1991).
g. T. A. Engler, M. A. Letavic, K. O. Lynch, Jr., and F. Takusagawa, J. Org. Chem., 59, 1179 (1994).
h. E. J. Corey, S. Sarshar, and D.-H. Lee, J. Am. Chem. Soc., 116, 12089 (1994).
i. E. J. Corey, T.-P. Loh, T. D. Roper, M. D. Azimioara, and M. C. Noe, J. Am. Chem. Soc., 114, 8290 (1992).
j. D. H. Ryu and E. J. Corey, J. Am. Chem. Soc., 125, 6388 (2003).
k. E. J. Corey, A. Guzman-Perez, and T.-P. Loh, J. Am. Chem. Soc., 116, 3611 (1994).
l. G. Quinkert, A. Del Grosso, A. Doering, and W. Doering, R. I. Schenkel, M. Bauch, G. T. Dambacher,
J. W. Bats, G. Zimmerman, and G. Durrer, Helv. Chim. Acta, 78, 1345 (1995).
m. D. A. Evans, D. M. Barnes, J. S. Johnson, T. Lectka, P. von Matt, S. J. Miller, J. A. Murry, R. D. Norcross,
E. A. Shaugnessy and K. R. Campos, J. Am. Chem. Soc., 121, 7582 (1999).
n. J. A. Marshall and S. Xie, J. Org. Chem., 57, 2987 (1992).
o. T. W. Lee and E. J. Corey, J. Am. Chem. Soc., 123, 1872 (2001).